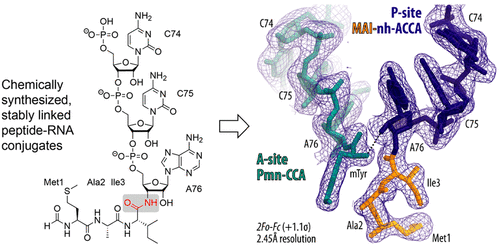
La biosíntesis de proteínas es un proceso central en todas las células vivas que es catalizado por una máquina molecular compleja: el ribosoma. Este proceso se denomina traducción porque el lenguaje de los nucleótidos en los ARNm se traduce al lenguaje de los aminoácidos en las proteínas. Las moléculas de ARN de transferencia (ARNt) cargadas con aminoácidos sirven como adaptadores y reconocen codones de ARNm en el centro de decodificación mientras que simultáneamente los aminoácidos individuales se ensamblan en una cadena peptídica en el centro de la peptidil transferasa (PTC). A medida que el péptido naciente emerge del ribosoma, es enhebrado a través de un largo túnel conocido como túnel de salida del péptido naciente (NPET). El PTC y el NPET son los sitios a los que se dirigen muchos antibióticos y, por lo tanto, son de enorme importancia desde una perspectiva biomédica y para el desarrollo de fármacos en la industria farmacéutica. Los investigadores han logrado un gran progreso en la caracterización de la traducción ribosómica a nivel molecular; ahora hay disponible una impresionante cantidad de estructuras de alta resolución de diferentes estados funcionales e inhibidos del ribosoma. Estas estructuras han contribuido significativamente a nuestra comprensión de cómo el ribosoma interactúa con sus sustratos clave, a saber, ARNm, ARNt y factores de traducción. En contraste, se sabe mucho menos sobre los mecanismos de cómo las moléculas pequeñas, especialmente los antibióticos, afectan la síntesis de proteínas ribosómicas. Esto se refiere principalmente a la base estructural de la interferencia de la NPET de moléculas pequeñas con el plegamiento de proteínas cotraduccionales y la regulación de la síntesis de proteínas. Cada vez hay más evidencia bioquímica que sugiere que la NPET desempeña un papel activo en la regulación de la síntesis de proteínas. El progreso muy necesario en este campo se ve obstaculizado por el hecho de que durante la preparación de complejos ribosómicos para estudios estructurales (es decir, cristalografía de rayos X, microscopía crioelectrónica y espectroscopia de RMN) los aminoacilos o peptidil-ARNt son inestables y se hidrolizan. Una solución a este problema es la aplicación de imitadores resistentes a la hidrólisis de aminoacil- o peptidil-ARNt. En este artículo, presentamos una descripción general de los métodos sintéticos para la generación de análogos de peptidil-ARNt. Se han desarrollado enfoques modulares que combinan ( i ) la síntesis en fase sólida de ARN y péptidos en resinas de 3′-aminoacilamino-adenosina, ( ii ) ligaduras químicas nativas y ligaduras de Staudinger, ( iii ) la adaptación de los ARNt mediante la escisión selectiva de ARNt nativos naturales con ADNzimas seguida de un reensamblaje con ligadura enzimática a fragmentos sintéticos de peptidil-ARN, y ( iv)) cola enzimática y carga de cisteína del ARNt para obtener extremos CCA modificados de un ARNt que se ligan químicamente a la fracción peptídica de interés. Con este arsenal de herramientas, en principio, cualquier secuencia deseada de un imitador de ARNt peptidil unido de manera estable es accesible. Para subrayar la importancia de los conjugados sintéticos, señalamos brevemente las aplicaciones más críticas que han arrojado nueva luz sobre los mecanismos moleculares subyacentes a la actividad específica del contexto de los antibióticos dirigidos a los ribosomas, la incorporación dependiente de los ribosomas de múltiples residuos de prolina consecutivos, la incorporación de d-aminoácidos y la carga incorrecta del ARNt. Además, analizamos nuevos tipos de análogos de ARNt con carga estable, que se basan en conjugados unidos por triazol y escuarato (en lugar de amida). Estos avances han hecho avanzar nuestra comprensión mecanicista de la síntesis de péptidos no ribosómicos, donde las enzimas dependientes de aminoacil-ARNt participan críticamente en varios procesos celulares en el metabolismo primario y secundario y en la síntesis de la pared celular bacteriana.
Fuente:
Polikanov YS, Etheve-Quelquejeu M, Micura R. Synthesis of Peptidyl-tRNA Mimics for Structural Biology Applications. Acc Chem Res. 2023 Oct 3;56(19):2713-2725. doi: 10.1021/acs.accounts.3c00412. Epub 2023 Sep 20. PMID: 37728742; PMCID: PMC10552525.